华东医药司美格鲁肽III期临床首例入组!6款GLP-1R药物进军千亿降糖减重市场!

转自:药通社
注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及),不代表平台立场。任何文章转载需要得到授权。
华东医药司美格鲁肽III期临床首例入组!6款GLP-1R药物进军千亿降糖减重市场。
2023年9 月 20 日,华东医药宣布,其长效胰高血糖素样肽-1(GLP-1)受体激动剂司美格鲁肽注射液 III 期临床试验完成首例患者入组及给药。
该研究是一项多中心、随机、开放、平行对照的III期临床研究,主要目的是在二甲双胍治疗后血糖控制不佳的2型糖尿病患者中论证试验药物司美格鲁肽注射液与对照药物司美格鲁肽注射液(诺和泰®)在治疗32周后血糖控制的等效性。

截图来源:药融云中国临床试验数据库
司美格鲁肽为GLP-1受体激动剂,GLP-1R类产品具有减肥、降糖和心血管获益等功效,是相对成熟稳定和安全的靶点。后续华东医药司美格鲁肽注射液也计划在国内启动用于肥胖或超重适应症的临床试验。
华东医药在降糖/减肥领域围绕GLP-1R靶点进行了差异化布局,已构筑包括口服、注射剂在内的长效及多靶点全球创新药和生物类似药相结合的全方位产品管线:其中利拉鲁肽注射液是国内首个获批肥胖或超重适应症的GLP-1R产品;目前在研的还包括生物类似药司美格鲁肽注射液、全球创新口服小分子GLP-1R激动剂HDM1002、双靶点激动剂HDM1005及SCO-094、长效三靶点激动剂DR10624等多款产品。
PART 01
国产首家:利拉鲁肽注射液
2023年3月30日,华东医药的利拉鲁肽注射液(商品名:利鲁平)用于控制成人2型糖尿病(T2DM)血糖的上市许可申请获批,是首款获批上市的国产利拉鲁肽注射液。2023年7月4日,利拉鲁肽注射液肥胖或超重适应症正式得到上市许可,拿下首个国产减肥针,有助于华东医药在减重赛道保持先发市场优势。

截图来源:药融云中国药品批文数据库
据药融云数据库,利拉鲁肽注射液近年院内市场销售额均在14亿元左右,目前仅有诺和诺德和华东医药拥有相关批文。

PART 02
口服小分子GLP-1受体激动剂:HDM1002
HDM1002是华东医药自主研发的口服小分子GLP-1受体激动剂,临床前研究显示,HDM1002可强效激活GLP-1受体,诱导环磷酸腺苷(cAMP)产生,具有强效的改善糖耐受、降糖和减重作用并且显示出良好的安全性。今年5月,HDM1002糖尿病适应症首获中美双IND批准,并于2023年6月初实现首次人体试验(FIH)首例受试者用药,该研究旨在初步探索HDM1002片在人体的安全性和耐受性、药代动力学和剂量效应关系等(登记号:CTR20231505)。2023年9月13日,CDE官网显示,由杭州中美华东制药有限公司申报1类新药HDM1002片通过临床试验默示许可,适应症为:用于超重或肥胖人群的体重管理。
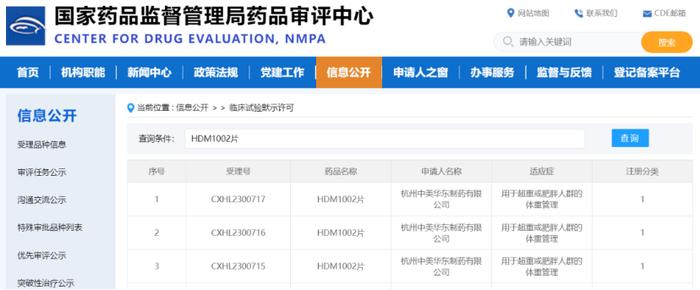
截图来源:CDE官网
PART 03
双靶点GLP-1R/GIPR激动剂:SCO-094和HDM1005
2023年年2月,华东医药获得日本SCOHIA PHARMA公司研发的药物SCO-094及其衍生产品的全球(含日本)独家开发、生产和商业化权利。该药物与礼来公司的替尔泊肽一起针对 GLP-1R 和 GIP 等双重受体,并已在英国成功进行了 I 期临床试验。临床前研究证明了 SCO-094 对预期靶标的强结合活性和生物学效应。动物模型显示其具有降低血糖、促进减肥、改善肝功能、降低甘油三酯和抑制肝脂肪变性的功效。临床前数据支持 SCO-094针对糖尿病、减肥和 NASH 等适应症的临床开发。该药物目前正在英国进行I期临床试验。

HDM1005 是一种长效多肽双靶点激动剂,靶向GLP-1R/GIPR,用于治疗糖尿病和肥胖症。公司目前正在进行该产品的临床前研究。
PART 04
长效GLP-1R/GCGR/FGF21R三靶点激动剂:DR10624
2023年5月18日,CDE官网显示,华东医药旗下道尔生物已提交国内首个“注射用DR10624”临床申请,并已获受理。 值得注意的是,DR10624是全球首个进入临床开发阶段的同类药物。

DR10624为全球首创(first-in-class)的一种靶向GLP-1受体(GLP-1R)、GCG受体(GCGR)和FGFR1c/Klothoβ(FGF21R)的长效三靶点激动剂。由N端靶向GLP-1R/GCGR的嵌合肽段与工程化改造的IgG1Fc融合,并在Fc的C末端融合重组的FGF21突变体。DR1024由中国仓鼠卵巢(CHO)细胞表达,经纯化后获得。DR10624结构上为对称二聚体,具有GLP-1R、GCGR与FGF21R三重激动剂的生物学活性,同时融合有去糖基化改造的IgG1Fc以延长半衰期。临床前的动物研究显示,DR10624具有明显的降脂、减重、降糖等疗效。DR10624已于2023年7月在新西兰完成了治疗肥胖症的I期多次递增剂量给药(MAD)临床试验的首例受试者给药。8月31日,DR1062在国内也启动了评价DR10624单次和多次皮下给药、剂量递增的安全性、耐受性、药代动力学和药效学的随机、安慰剂对照、双盲、Ⅰ期研究,适应症为超重或肥胖人群的体重管理。(登记号:CTR20232684)。
结语
GLP-1R药物的研发在国内外均吸引众多药企的布局,利拉鲁肽、度拉糖肽、司美格鲁肽、替尔泊肽四款产品的商业化成功彻底点燃了该赛道的研发热情。降糖减重的千亿美元市场有着无限的想象空间,华东医药在GLP-1R药物的多方位的布局非常值得国内其他药企学习。红海市场将至,华东医药已做好充足准备。

